§8. Периодическая система химических элементов
Опираясь на периодический закон, Д. И. Менделеев построил естественную классификацию химических элементов — периодическую систему химических элементов. Её графическим изображением является таблица, которая так и называется — периодическая система химических элементов.
Каждый химический элемент в таблице занимает одну клетку, в которой указаны химический знак элемента, его название, значение относительной атомной массы и его атомный номер, который также часто называют порядковым.
Период – горизонтальный ряд химический элементов, расположенных в порядке возрастания их относительных атомных масс, начинающийся со щелочным металлом (или водородом) и заканчивающийся благородным газом.
Всего в таблице семь периодов. Их номера указаны цифрами, стоящими слева. Каждый период содержит определенное число химических элементов.
1 Период - 2 элемента
2 Период - 8 элементов
3 Период - 8 элементов
4 Период - 18 элементов
5 Период - 18 элементов
6 Период - 32 элемента
7 Период - 32 элемента
Первые три периода называются малыми периодами. Остальные четыре периода называются большими. В них так же, как и во втором и третьем, наблюдается постепенное ослабление металлических и усиление неметаллических свойств атомов и простых веществ элементов, только переход идет от щелочного металла к благородному газу через большее число элементов, более плавно.
Группа - вертикальный столбец химических элементов в периодической системе, атомы которых обладают сходными свойствами.
Всего в таблице восемнадцать групп, пронумерованных арабскими цифрами. Кроме того, группы имеют традиционную нумерацию римскими цифрами, сохранившуюся со времен Д. И. Менделеева, — от I до VIII с добавлением латинских букв А или В.
Группы А часто называют главными. Они включают все элементы первых трех (малых) периодов, а также нижестоящие элементы больших периодов. В этих группах находятся как металлы, так и неметаллы. Граница между этими двумя типами элементов обычно выделяется жирной линией. Эта граница достаточно условна, так как некоторые элементы, находящиеся возле нее, могут проявлять как металлические, так и неметаллические свойства.
Некоторые главные группы имеют свои собственные названия:
I А-группа — это группа щелочных металлов + водород Н,
II А-группа — группа щелочноземельных металлов + бериллий Be и магний Mg,
VI А-группа — группа халькогенов,
VII A-группа — группа галогенов,
VIII A-группа — группа благородных газов и т. д.
Между I—II А и III—VIII A-группами располагаются переходные элементы групп В. Группы В иногда называют побочными. В них находятся только элементы больших периодов, и они все являются металлами Эти группы также имеют собственные названия, обычно связанные с названием первого элемента в группе.
В каждой группе находятся элементы со сходными химическими свойствами их атомов. Номер группы (римскими цифрами (указывает, как правило, высшую, т.е. максимальную, валентность элементов в соединениях с кислородом.
Максимальные валентности и формулы высших оксидов элементов А- и В-групп
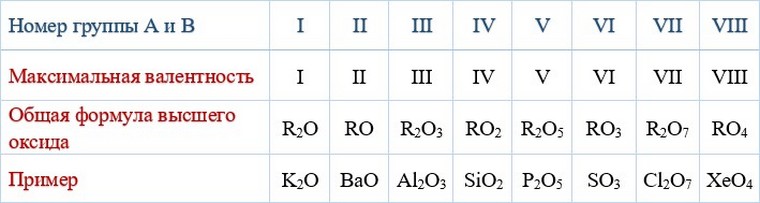
Атомы некоторых элементов проявляют и другие значения высшей валентности (Сu, Аu) или просто не имеют кислородных соединений (Не, Ne, Аr).
Итак, сегодня мы узнали:
- Графическим изображением периодического закона является таблица периодической системы элементов.
- Каждый химический элемент имеет свой атомный номер, находится в определенном периоде и в определенной группе таблицы.
- Период — горизонтальный ряд химических элементов, начинающийся щелочным металлом (или водородом) и заканчивающийся благородным газом.
- Группа — вертикальный столбец химических элементов со сходными свойствами их атомов.
ЭТО ИНТЕРЕСНО
Лантанидами называют редкоземельные элементы. Степень окисления всегда +3. Соединения лантанидов применяются в электронно–вычислительных устройствах. Стекла, содержащие соединения лантанидов, задерживают ультрафиолетовые лучи. Поэтому из таких стекол изготавливают защитные очки для сварщиков, стеклодувов и металлургов, а также сосуды для хранения лекарств.
Практически важным лантанидом является церий – Се. Его сплав с железом при трении легко искрит, поэтому из него изготавливают камни для зажигалок. Сплавы с небольшими добавками церия улучшают их коррозийную стойкость, жаростойкость, твердость, прочность и пластичность.
Все актиниды радиоактивны. Степень окисления от +2 до +7. Уран, плутоний и некоторые другие актиниды используют для получения ядерной энергии.
Теги материала:




