§6. Понятие о естественных свойствах элементов

После того как выяснилось, что классификация на металлы и неметаллы не является полной, ученые стали выделять из этих двух больших классов элементы, особенно близкие по свойствам их простых веществ. Такие группы элементов назвали естественными семействами.
Щелочные металлы. Прежде всего в одно семейство были объединены элементы, простые вещества которых обладают наиболее ярко выраженными металлическими свойствами: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs. Их назвали щелочными металлами, так как они энергично взаимодействуют с водой с образованием щелочей.
Уравнение химической реакции взаимодействия металлического натрия с водой:
$\mathrm{2Na+2H_{2}O=2NaOH+H_{2} \uparrow}$
Энергично реагируют щелочные металлы также с кислородом, хлором, серой и другими неметаллами. Весьма близки по свойствам и их соединения: оксиды, которые все проявляют основные свойства - реагируют с водой и кислотами:
$\mathrm{Li_{2}O+H_{2}O=2LiOH;}$
$\mathrm{Na_{2}O+2HCl=2NaCl+H_{2}O.}$
и гидроксиды, являющиеся щелочами. (Вспомните, как это можно доказать.)
В таблице приведены некоторые физические свойства простых веществ этих элементов и формулы их типичных соединений.
Физические свойства щелочных металлов и их соединений
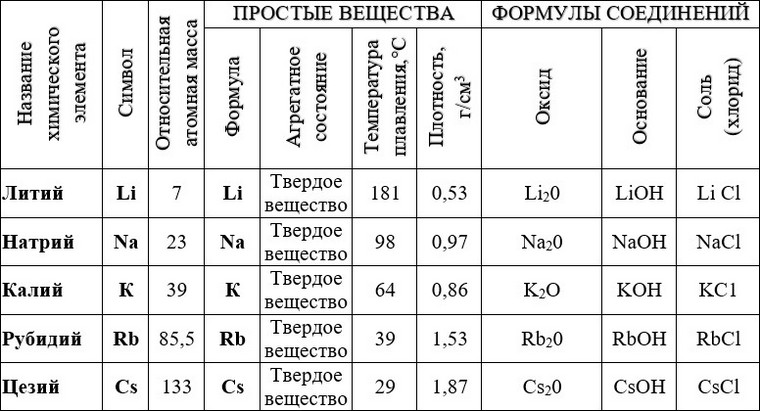
Щелочные металлы — мягкие (они легко режутся ножом), легкие, пластичные, легкоплавкие, хорошо проводят электрический ток, обладают металлическим блеском.
Соединения щелочных металлов (оксиды, гидроксиды и др.) имеют сходный состав и проявляют подобные свойства. Таким образом, можно сделать вывод о сходстве щелочных металлов на основе сходства физических и химических свойств их простых веществ и однотипных соединений.
Галогены. Естественным семейством элементов, у простых веществ которых наиболее ярко проявляются неметаллические свойства, является группа галогенов (фтор F, хлор Сl, бром Вr, йод I). Молекулы простых веществ галогенов двухатомны: F2, Сl2, Вг2, I2.
Простые вещества этих элементов активно реагируют с металлами с образованием солей:
$\mathrm{Mg+Cl_{2}=MgCl_{2};}$
Отсюда и название этого семейства «галогены», что в переводе с греческого языка означает «рождающие соли».
Еще одно характерное химическое свойство галогенов — взаимодействие с водородом. При этом образуются газообразные вещества, которые называются галогеноводороды:
$\mathrm{H_{2}+F_{2} \rightarrow 2HF}$
$\mathrm{H_{2}+F_{2} \xrightarrow{h \nu} 2HF}$
$\mathrm{H_{2}+F_{2} \xrightarrow{t} 2HF}$
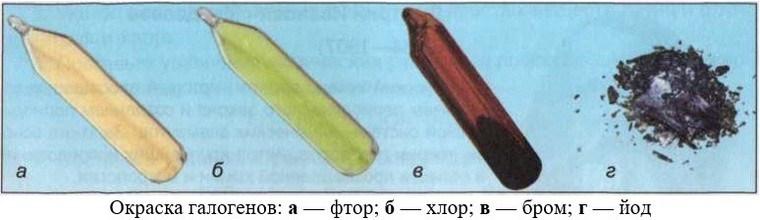
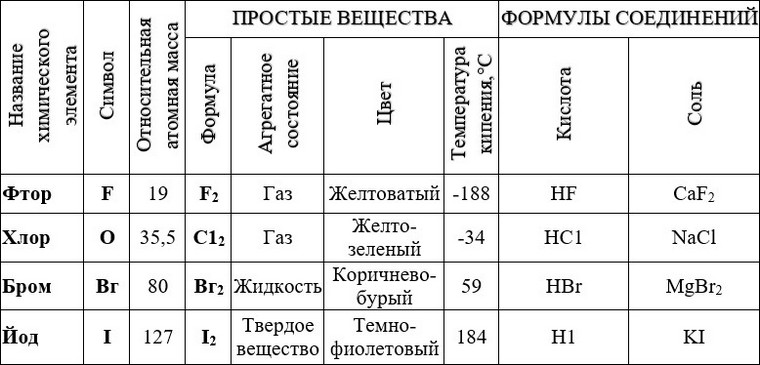
Водные растворы галогеноводородов — кислоты. Окраска простых веществ галогенов показана на рисунке, а физические свойства и формулы их типичных соединений приведены в таблице.
Щелочные металлы и галогены обладают во многом противоположными свойствами. Щелочные металлы являются типичными металлами, а галогены — типичными неметаллами.
Известны и другие естественные семейства химических элементов с близкими свойствами. Например, в конце XIX в. была открыта группа элементов, простые вещества которых получили название благородные газы: гелий Не, неон Ne, аргон Аr, криптон Kr, ксенон Хе. Они отличаются исключительной инертностью и не образуют соединений ни с металлами, ни с водородом.
Физические свойства галогенов и их соединения
Теги материала:



