§22. Окислительно-восстановительные реакции
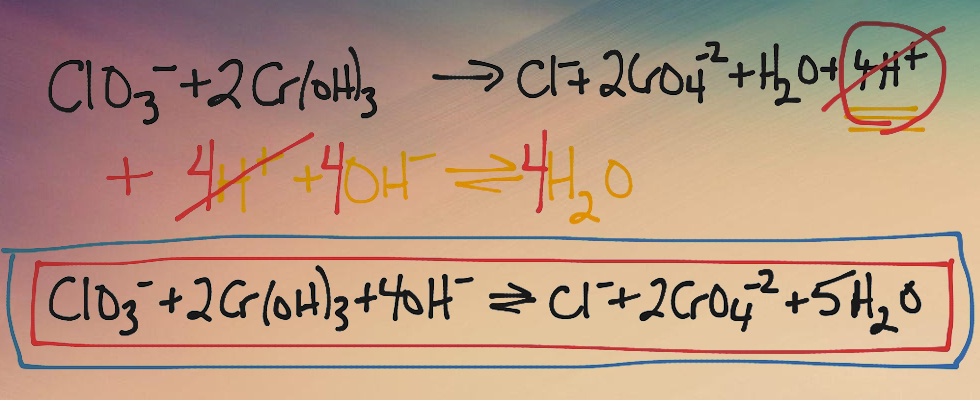
Окислительно - восстановительные реакции – это реакции, протекающие с изменением степени окисления элементов.
Например, рассмотрим реакцию взаимодействия железа с хлоридом меди:
Записываем уравнение реакции:
$\mathrm{Fe+CuCl_{2}=FeCl_{2}+Cu}$
Проставляем степень окисления над знаками элементов, у которых они меняются:
$\mathrm{Fe^{0}+Cu^{+2}Cl^{-1}_{2}=Fe^{+2}Cl^{-1}_{2}+Cu^{0}}$
Выписываем химические знаки элементов, атомы или ионы которых меняют степень окисления:
$\mathrm{Fe^{0}\rightarrow Fe^{+2}}$
$\mathrm{Cu^{+2}\rightarrow Cu^{0}}$
Находим, сколько электронов отдают или присоединяют соответствующие атомы или ионы:
$\mathrm{Fe^{0}-2e^{-}\rightarrow Fe^{+2}}$
Процесс отдачи электронов атомами элемента называется окислением. Атомы, молекулы или ионы, которые в ходе химической реакции отдают электроны, называются восстановителями.
Значит, в рассматриваемом процессе происходит окисление атомов железа, которые выступают в роли восстановителей.
$\mathrm{Cu^{+2}+2e^{-}\rightarrow Cu^{0}}$
Процесс присоединения электронов атомами элемента называется восстановлением. Атомы, молекулы или ионы, которые в ходе химической реакции присоединяют электроны, называются окислителями.
Таким образом, в рассматриваемом процессе происходит восстановление ионов меди, которые выступают в роли окислителей.
Записываем рядом число отданных или присоединенных электронов (число электронов, которые отдает восстановитель, равно числу электронов, которые присоединяет окислитель) и находим наименьшее общее кратное этих чисел:
$\mathrm{Fe^{0}-2e^{-}\rightarrow Fe^{+2},~ НОК ~-~2,~~ 1~коэффициент}$
$\mathrm(Cu^{+2}+2e^{-}\rightarrow Cu^{0},~ НОК ~-~2,~~ 1~коэффициент)$
Найденные коэффициенты ставят перед соответствующими формулами в правой части уравнения.
Соответственно найденным коэффициентам в правой части уравнения находят коэффициенты для формул всех остальных веществ:
$\mathrm{Fe+CuCl_{2}=FeCl_{2}+Cu}$
Проверяем, соответствует ли число атомов всех элементов в левой части уравнения числу атомов в правой части уравнения.
ВИДЫ ОВР:
В окислительно-восстановительных реакциях окислитель и восстановитель чаще всего являются разными веществами. Такие окислительно-восстановительные реакции называются межмолекулярными.
Если окислитель и восстановитель находятся в составе одного вещества (но это атомы разных элементов), то такие окислительно-восстановительные реакции носят название внутримолекулярных.
Реакции самоокисления-самовосстановления. В ходе этих реакций атомы одного и того же элемента, находящиеся в составе одного вещества, являются и окислителями (понижают степень окисления) и восстановителями (повышают степень окисления). Это реакции диспропорционирования.
Теги материала:



