§ 1,2. Важнейшие химические понятия

Все физические тела состоят из веществ. Одни тела состоят только из одного вещества, а другие — из нескольких. Любое вещество характеризуется определенными физическими и химическими свойствами. Именно поэтому их можно отличать друг от друга.
Вещества способны при определенных условиях превращаться в другие вещества. Такие превращения называются химическими или химическими реакциями.
Химия – это наука о веществах и их превращениях.
Современная химия насчитывает более 60 млн различных веществ.
Все вещества состоят из атомов — мельчайших, химически неделимых частиц. Видов атомов сравнительно немного.
Каждый определенный вид атомов называется химическим элементом. Всего в настоящее время известно 118 элементов. Любой элемент имеет свое собственное название и условное обозначение — химический символ (знак).
Каждый элемент характеризуется относительной атомной массой. Это физическая величина, которая показывает, во сколько раз средняя масса атомов данного химического элемента больше части массы атома углерода.
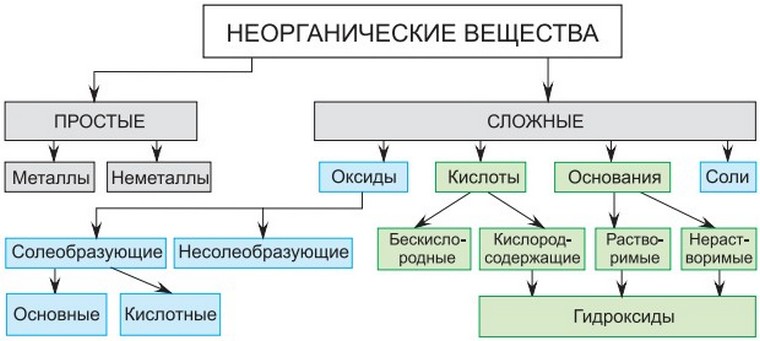
Если вещества состоят из атомов одного вида, то они называются простыми веществами, например кислород 02, фосфор Р4 и др.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Молекула — наименьшая электронейтральная частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Например, молекулы хлора Сl2, воды Н20, оксида серы(IV) S02, фосфорной кислоты Н3Р04 и др. При обычных условиях молекулярные вещества могут быть газообразными, жидкими и твердыми (с относительно низкими температурами плавления).
Вещества немолекулярного строения обычно представляют собой твердые кристаллы, построенные из атомов или ионов. К ним относятся, например, кристаллы железа Fe, алмаза С, хлорида натрия NaCI.
Качественный и количественный состав любого вещества выражают в химии в виде химической формулы. Химические формулы веществ молекулярного строения (молекулярные формулы) показывают состав молекул, т. е. структурных единиц веществ такого типа, например: С02, SO3. Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Мr. Эта величина равна сумме относительных атомных масс химических элементов, образующих данную молекулу, с учетом индексов у символов атомов в молекулярной формуле.
Состав веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение атомов элементов в веществе, например: CaS04, FeCl2. Они называются формульными единицами и выполняют роль структурных единиц веществ немолекулярного строения. К веществам немолекулярного строения относятся, например, железо Fe, хлорид натрия NaCl, сульфат кальция CaS04 и др. Такие вещества характеризуются величиной относительной формульной массы, которая также обозначается Мr.
Химическое количество вещества (обозначается n) – физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Единицей химического количества вещества является моль.
Число атомов, находящихся в 0,012 кг углерода, равно 6,02·1023 (число Авогадро). Эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества. Величина, равная отношению
$\mathrm{N_{A}=\frac{6,02 \cdot 10^{23}}{1~моль}=6,02 \cdot 10^{23} \frac{1}{моль}=6,02 \cdot 10^{23} ~моль^{-1}.}$
получила название постоянной Авогадро (NA).
Зная химическое количество данного вещества n(Х), легко рассчитать N(Х) — число структурных единиц (атомов, молекул, формульных единиц) в этой порции:
$\mathrm{N(X)=N_{A} \cdot n(X).}$
Масса порции вещества химическим количеством 1 моль получила название молярной массы М(X):
$\mathrm{M(X)=\frac{m(X)}{n(X)}=[\frac{г}{моль}]~или~[\frac{кг}{моль}].}$
Молярная масса любого вещества (в г/моль) численно равна его относительной молекулярной (формульной) массе:
$\mathrm{M_{r}(H_{2}SO_{4})=98~а.е.м.;~M(H_{2}SO_{4})=98 \frac{г}{моль};}$
$\mathrm{M_{r}(Mg)=A_{r}(Mg)=24~а.е.м.;~M(Mg)=A_{r}(Mg)=24 \frac{г}{моль};}$
$\mathrm{M_{r}(CaCO_{3})=100~а.е.м.;~M(CaCO_{3})=100 \frac{г}{моль}.}$
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом Vm.
$\mathrm{V_{m}(X)=\frac{V(X)}{n(X)},~следовательно~n(X)=\frac{V(X)}{V_{m}(X)}}$
При нормальных условиях (температура 0 °С и давление 101,325 кПа) отношение объема любой порции газа к его химическому количеству есть величина постоянная и равная 22,4 дм3/моль:
$\mathrm{V_{m}=22,4 \frac{дм^{3}}{моль}}$
Эта величина и есть молярный объем газа при нормальных условиях.
Издавна стали классифицировать вещества по их природному происхождению. Так появились термины органические и неорганические вещества.
Теги материала:



