§16. Ковалентная связь
Все молекулы образованы из атомов за счет ковалентной связи.
Ковалентная связь — это химическая связь, возникающая в результате образования общих электронных пар между двумя атомами.
Пример 1. Рассмотрим образование молекулы водорода:
У каждого атома водорода на внешнем (первом) электронном слое находится по одному электрону.
До завершения этого слоя не хватает одного электрона.
При сближении атомов ядро каждого из них притягивает к себе электронное облако другого.
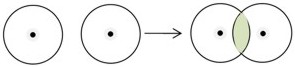
Между ядрами возникает область повышенного отрицательного заряда, которую обычно что называют областью повышенной электронной плотности (облака обоих атомов перекрываются).
Ядра атомов стягиваются к этой области до тех пор, пока не наступит равновесие между силами межъядерного отталкивания и силами притяжения.
Между атомами возникает прочное взаимодействие, которое и называется химической связью.
Каждый атом водорода получил по недостающему электрону на внешний электронный слой, тем самым завершив его построение.
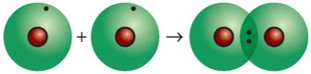
При этом образуется общая электронная пара, которая принадлежит обоим атомам одновременно.
Схематически образование молекулы водорода можно изобразить так:
$\mathrm{H.+ \cdot H \rightarrow H^{\cdot}_{\cdot}H}$
Точками на схемах обозначаются электроны внешнего электронного слоя, а двумя точками в формуле — пара электронов. Такие формулы, в которых изображаются все электроны внешнего электронного слоя атома, называют электронными формулами.
- Обобществленная пара электронов часто показывается с помощью черточки, например:
$\mathrm{H \! - \! H}$
Эта черточка обозначает ковалентную связь. Ковалентная связь возникает между атомами неметаллов.
Пример 2. Рассмотрим образование более сложной молекулы хлора Сl2.
- Атомы хлора, как и атомы остальных элементов VIIA-группы, имеют на внешнем электронном слое семь электронов.
- Каждому атому до завершения внешнего слоя не хватает всего одного электрона.
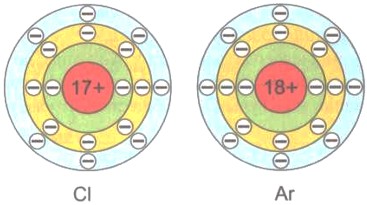
Схема электронного строения атомов хлора и аргона
- При сближении атомов хлора происходит перекрывание электронных облаков их неспаренных электронов. Эти электроны становятся общими для обоих атомов (каждый из атомов хлора построил для себя завершенный внешний электронный слой с необходимыми восемью электронами).
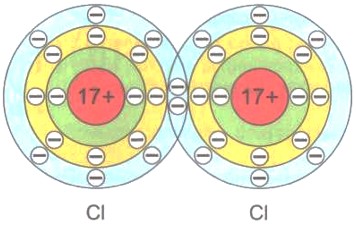
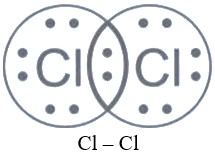
Схема образования общей электронной пары в молекуле хлора
- Электронная схема строения молекулы хлора:
$\mathrm{_{\cdot}^{\cdot} \overset{ \cdot \cdot}{\underset{\cdot \cdot}{Cl}} \! \cdot+ \cdot \! \overset{ \cdot \cdot}{\underset{\cdot \cdot}{Cl_{\cdot}^{\cdot}}} \rightarrow \overset{ \cdot \cdot}{\underset{\cdot \cdot}{_{\cdot}^{\cdot}Cl_{\cdot}^{\cdot}}} \overset{ \cdot \cdot}{\underset{\cdot \cdot}{Cl_{\cdot}^{\cdot}}}}$
- Графическая (структурная) схема строения молекулы хлора:
$\mathrm{\shortmid \overset{-}{\underset{-}{Cl}} \! - \! \overset{ -}{\underset{-}{Cl}} \shortmid}$
Пары электронов внешнего электронного слоя, которые не участвуют в образовании связей, также показываются на схемах с помощью черточек.
Кратность связей
- Если атомы соединены между собой с помощью одной общей электронной пары, то такая ковалентная связь называется одинарной.
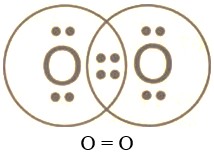
- Если атомы соединены между собой двумя общими электронными парами, то такая ковалентная связь называется двойной.
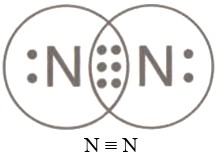
- Если атомы соединены между собой тремя общими электронными парами, то такая ковалентная связь называется тройной.
Теги материала:



