§15. Природа химической связи

Разные вещества имеют различное строение: одни существуют в виде свободных атомов, другие состоят из связанных атомных частиц. Только благородные газы являются одноатомными молекулами, а остальные представляют собой самые разнообразные соединения. Взаимодействие, т.е. совокупность сил, которые обеспечивают существование таких агрегатов (молекул, кристаллов, радикалов и др.) получило название химическая связь.
Химическая связь – это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, кристаллы и т.д.)
Причина образования химической связи – это стремление атомов путем взаимодействия друг с другом достичь более устойчивого состояния с минимальной затратой энергии. Энергия многоатомной системы меньше по сравнению с суммарной энергией изолированных атомов.
Таким образом, образование химической связи всегда сопровождается выделением энергии.
Природа сил химической связи – электростатическая, т.е. обусловлена взаимодействием положительно заряженных ядер и отрицательно заряженных электронов.
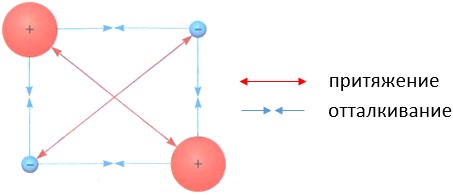
Схема электростатических взаимодействий в системе из двух ядер и двух электронов
Давайте вспомним сколько атомов может содержаться на электронном слое. У неона и у всех благородных газов завершенный энергетический слой. Они в VIIIА группе, а номер группы указывает на количество электронов на внешнем слое. У атомов остальных элементов внешний слой незавершенный, поэтому в процессе химического взаимодействия атомы стремятся их завершить, т. е. приобрести электронное строение атома ближайшего благородного газа. Достичь такого электронного состояния атомы могут только за счёт обобществления электронов, т. е. их совместного использования атомами, соединяющимися между собой. При этом образуются общие электронные пары, которые связывают атомы друг с другом и между ними возникает химическая связь.
В зависимости от способа обобществления электронов различают три основных типа химической связи: ковалентную, ионную и металлическую.
Теги материала:



