§13. Периодичность изменения свойств атомов элементов

С точки зрения современной науки атом не имеет строго определенных границ, поскольку электронные облака составляющих его электронов также не имеют точных размеров. Условно форму атома считают шарообразной, и поэтому характеристикой его размера является радиус атома. Самым маленьким является атом гелия He, а самым большим — атом франция Fr, элемента IА-группы. Их радиусы различаются почти в 7 раз.
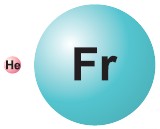
Радиус атома в основном определяется зарядом его ядра, количеством электронных слоев и числом электронов на внешнем слое. У элементов групп А с увеличением атомного номера растет число электронных слоев, и, следовательно, увеличиваются радиусы атомов.
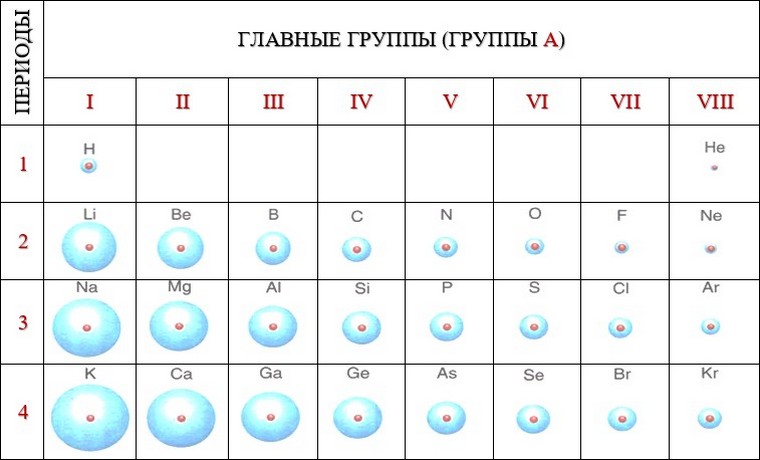
В периоде по мере увеличения зарядов ядер атомов элементов притяжение электронов, находящихся на одном и том же внешнем слое, к ядру усиливается. Происходит своего рода «сжатие» атомов, и их радиусы уменьшаются.
МЕТАЛЛИЧЕСКИЕ И НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
Проявление металлических свойств определяется прежде всего способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т.е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
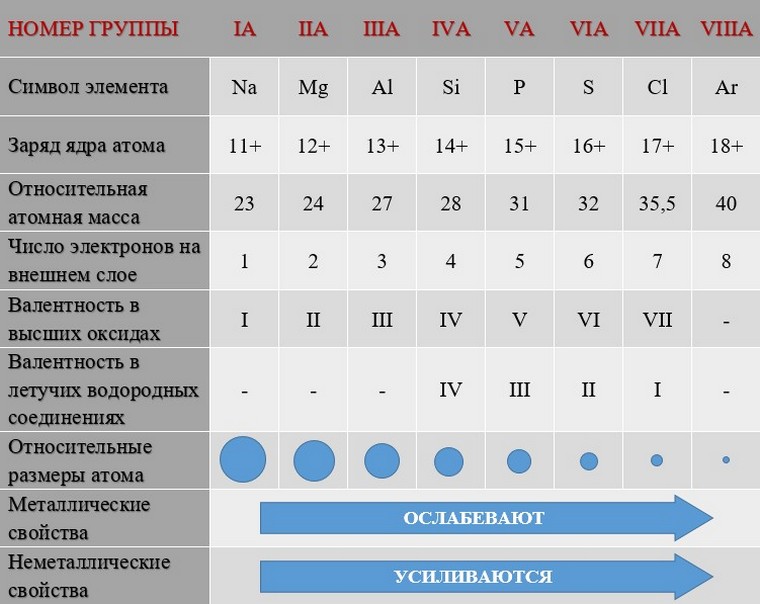
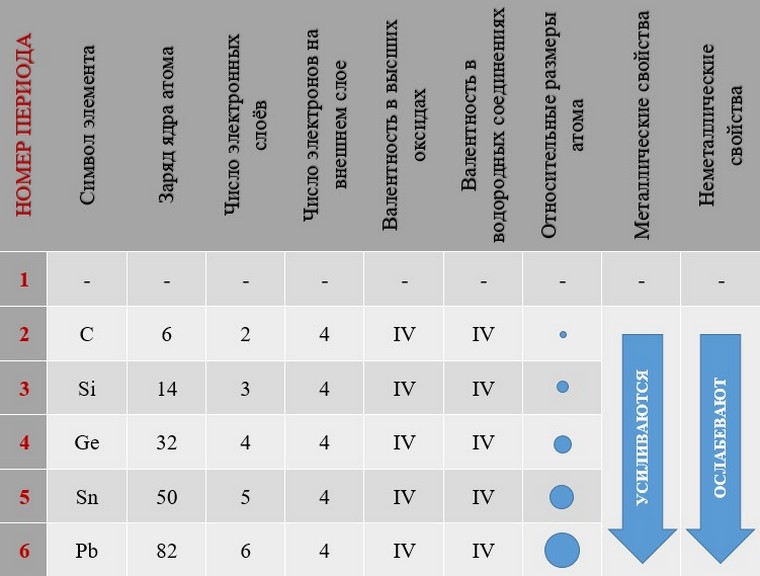
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. В периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным.
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере III периода и IVA-группы показаны в таблицах:
Теги материала:



