§12. Строение электронных оболочек атома

Общее число электронов в атоме известно — оно равно заряду ядра. Но электроны, обладая различным запасом энергии, по-разному располагаются в атоме. Чем выше энергия электрона, тем дальше он может находиться от ядра, и, следовательно, тем больше по размеру его орбиталь. И наоборот, электроны, обладающие меньшей энергией, движутся в основном вблизи ядра. Так образуются как бы оболочки (слои) из электронов с близкими значениями энергии, которые так и называются — электронные оболочки (электронные слои).
Электронный слой — это совокупность электронов с близкими значениями энергии.
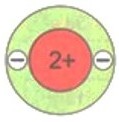
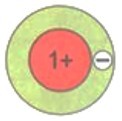
Число электронов на том или ином слое различно и в основном определяется их энергией. На первом электронном слое максимально может находиться 2 электрона. Схематично для атомов водорода и гелия это можно изобразить так, как показано на рисунке.
$\mathrm{_{1}H~1e^{-}}$
$\mathrm{_{2}He~2e^{-}}$
У атомов следующего элемента периодической системы лития Li имеется уже три электрона. Два расположены на первом электронном слое, который считается завершенным. Третий электрон обладает большей энергией, поэтому находится дальше от ядра, начиная формирование второго электронного слоя, который является внешним по отношению к первому слою.
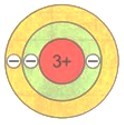
$\mathrm{_{3}Li~2e^{-},~1e^{-}}$
Графическое изображение распределения электронов по слоям называется электронной схемой атома.
У элементов, следующих за литием, возрастает заряд ядра атомов, а следовательно, и число электронов. Они постепенно заполняют второй электронный слой вплоть до 8 электронов у атома неона Ne.
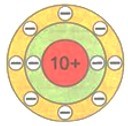
$\mathrm{_{10}Ne~2e^{-},~8e^{-}}$
Восемь — это максимальное число электронов второго электронного слоя. У атома натрия Na, следующего за неоном элемента, начинается заполнение третьего электронного слоя: от одного электрона у атома натрия Na до восьми у атома аргона Аr.
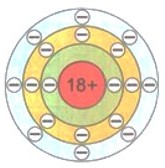
$\mathrm{_{11}Na~2e^{-},~8e^{-},~1e^{-}}$
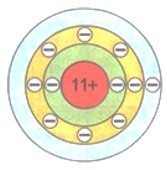
$\mathrm{_{18}Ar~2e^{-},~8e^{-},~8e^{-}}$
Упрощенно электронные схемы атомов изображают таким образом:
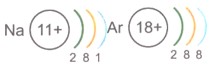
Внешний электронный слой, который содержит 8 электронов, называется завершенным.
Нетрудно сделать вывод, что число электронных слоев в атоме любого элемента совпадает с номером периода, в котором он находится. В этом заключается физический смысл (сущность) номера периода.
Сопоставим электронное строение атомов элементов первых трех периодов. На внешнем электронном слое атомов элементов одной группы содержится одинаковое число электронов. Так, литий Li, натрий Na, калий К имеют на внешнем слое по одному электрону, бериллий Be, магний Mg — по два, бор В, алюминий Аl — по три и т. д. У атомов благородных газов неона Ne и аргона Аr на внешнем слое по 8 электронов. Следовательно, строение внешнего электронного слоя атомов периодически повторяется.
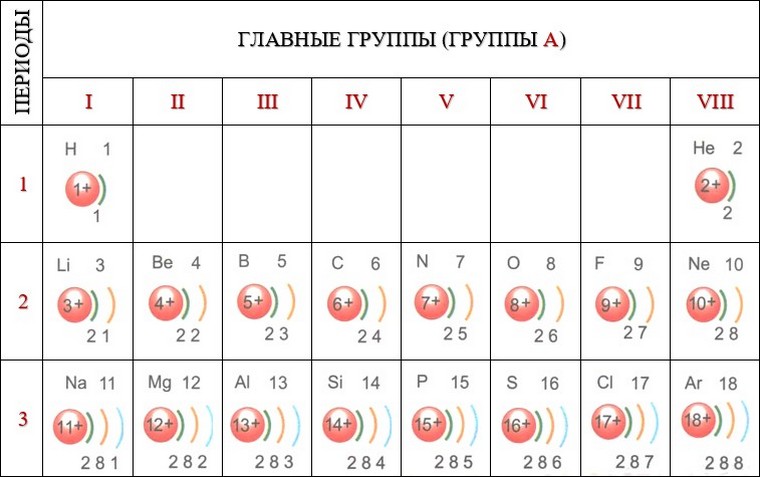
Электроны внешнего слоя связаны с ядром слабее, чем остальные, поэтому подвижны.
Они определяют химические свойства данного атома, т. е. его способность взаимодействовать с другими атомами. Такие электроны называют валентными.
Нетрудно заметить, что у атомов элементов A-групп число валентных электронов равно номеру группы, обозначенному римской цифрой. Эта закономерность отражает физический смысл номера А-группы.
Именно в этом заключается физический смысл (сущность) периодическою закона.
ЭТО ИНТЕРЕСНО
Посмотрим в таблицу Д.И. Менделеева на количественное распределение элементов в периодах:
в первом периоде 2 элемента,
во втором периоде 8 элементов,
в третьем периоде 8 элементов,
в четвертом периоде 18 элементов,
в пятом периоде 18 элементов,
в шестом периоде 32 элемента,
в седьмом периоде 32 элемента.
А теперь посмотрим на распределение электронов по слоям:
на первом слое максимум 2 электрона,
на втором слое максимум 8 электронов,
на третьем слое максимум 8 электронов,
на четвертом слое максимум 18 электронов,
на пятом слое максимум 18 электронов,
на шестом слое максимум 32 электрона,
на седьмом слое максимум 32 электрона.
Если вы забыли максимальное количество электронов на слоях, достаточно посмотреть в таблицу Д. И. Менделеева на количество элементов в периоде, помня, что номер периода соответствует количеству электронных слоев.
Итак, сегодня мы узнали:
1. Электроны с близкими значениями энергии составляют электронный слой.
2. Число электронных слоев в атоме любого элемента равно номеру периода, в котором он находится.
3. На внешнем электронном слое атомов максимально может находиться не более восьми электронов. Такой электронный слой называется завершенным.
4. Электроны внешнего слоя называются валентными.
5. Периодическая повторяемость свойств атомов химических элементов объясняется периодическим повторением строения их внешних электронных слоев.
Теги материала:



