урок 9. Первоначальные представления о валентности
Вы уже знаете, что в любом химическом соединении атомы разных элементов находятся в определенном количественном соотношении. Атомы одних элементов связаны только с одним атомом другого элемента, атомы других — с двумя, тремя и даже большим числом других атомов. От чего это зависит?
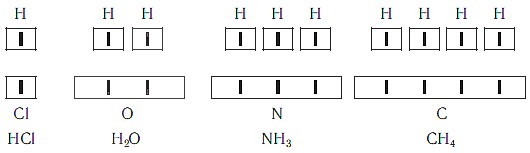
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:

Нетрудно заметить, что атом хлора связан с одним атомом водорода, кислорода — с двумя, азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа С02 — атом углерода связан с двумя атомами кислорода. Другими словами, у атомов разных элементов разная способность соединяться с другими атомами.
Количественно такая способность атома выражается с помощью характеристики, называемой валентностью.
Валентность — мера способности атомов данного элемента соединяться с атомами других элементов.
Так как атом водорода не соединяется больше чем с одним атомом другого элемента, то его валентность принята равной единице. Поэтому во всех вышеуказанных соединениях с другими элементами он одновалентен. Тогда в соединениях е водородом у атома хлора валентность равна единице, у кислорода — двум, азота — трем и у атома углерода — четырем. Схематически, если обозначить, единицу валентности черточкой |, это можно изобразить таким образом:
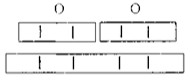
Необходимо соблюдать простое правило: суммарные числа единиц валентности атомов обоих элементов должны быть равны.
Так, в молекуле воды Н20 число единиц валентности водорода равно произведению его валентности на индекс в формуле:
$\mathrm{I \cdot \color{cyan}{2=2}}$
Точно так же определяют число единиц валентности кислорода:
$\mathrm{II \cdot \color{cyan}{2=2}}$
Например, определим валентность углерода в молекуле углекислого газа. Формула углекислого газа С02:
$\mathrm{\overset{X}{\color{cyan}{C}}\overset{II}{\color{cyan}{O}}_{\color{cyan}{2}}}$
Согласно правилу валентности X · 1 = II · 2, откуда X = IV.
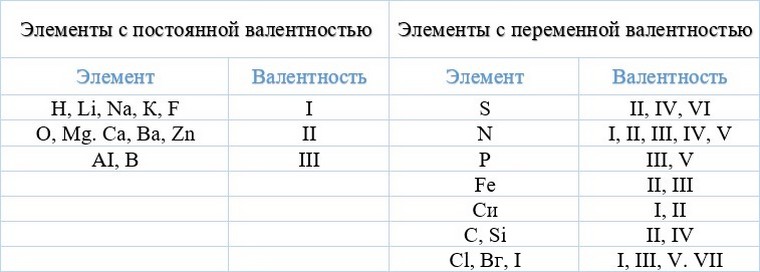
У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Валентность атомов некоторых элементов в соединениях
Зная валентность элементов, можно составлять формулы бинарных (вещества из двух хим. элементов) соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков:
1. Записать символы химических элементов и их валентности
2. Найти наименьшее общее кратное (НОК) валентностей обоих элементов
3. Разделить НОК на валентность каждого элемента (т.е. найти значения их индексов)
4. Записать индексы возле знаков химических элементов (индекс «1» не пишут).
Итак, сегодня мы узнали:
- Мерой способности атомов данного элемента соединяться с атомами других элементов является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам бинарных соединений с водородом или кислородом.
Теги материала:



