урок 6. Относительная атомная масса элемента
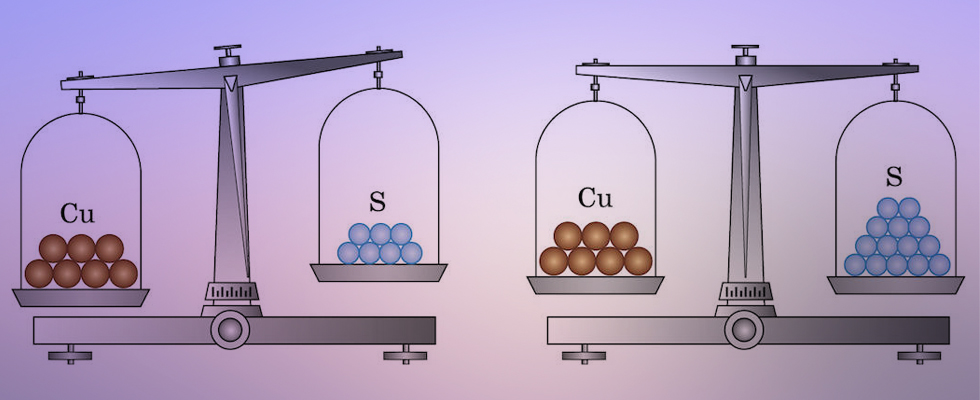
Атомы разных элементов различается между собой массой, размерами и строением. На рисунке 31 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные.
Шаровые модели атомов химических элементов
РАЗМЕРЫ И МАССА АТОМОВ
 Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода H. Его масса равна 0,0000000000000000000000000016735 (кг). Самым маленьким является атом гелия Не. Диаметр этого атома равен приблизительно 0,00000000098 (м). Прочитать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10-27 (кг) и 9,8·10-11 (м). Самый большой из химических элементов - Франций Fr, он больше атома гелия в 7 раз.
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода H. Его масса равна 0,0000000000000000000000000016735 (кг). Самым маленьким является атом гелия Не. Диаметр этого атома равен приблизительно 0,00000000098 (м). Прочитать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10-27 (кг) и 9,8·10-11 (м). Самый большой из химических элементов - Франций Fr, он больше атома гелия в 7 раз.
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом mа и измеряется в единицах массы СИ (кг).
Так, например, масса атома углерода равна: mа(С) = 19,94·10-27 (кг), а атома кислорода — mа(О) = 26,56·10-27 (кг). Масса атома самого тяжелого из существующих на Земле элементов — урана почти в 237 раз больше массы атома водорода.
АТОМНАЯ ЕДИНИЦА МАССЫ
На практике вместо истинных масс атомов стали применять их относительные величины. Для этого массы атомов различных элементов сравнивали с массой атома какого-нибудь элемента или с частью его массы, которую принимали за эталон, т. е. образец для сравнения. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода. Она получила название атомной единицы массы (а.е.м.). Ее международное обозначение — u (от английского слова «unit» — единица):

1/12 часть атома углерода
$\mathrm{1~а.е.м.=\frac{m_{a}(C)}{12}=\frac{19,94 \cdot 10^{-27}~кг}{12}=1,66 \cdot 10^{-27}~кг}$
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента Аr — это физическая величина, которая показывает, во сколько раз средняя масса атомов данного химического элемента больше 1/12 части массы атома углерода.
$\mathrm{A_{r}(X)=\frac{m_{a}(X)}{1~а.е.м.},}$
где X — символ данного элемента.
Например, относительная атомная масса водорода:
$\mathrm{A_{r}(H)=\frac{m_{a}(H)}{1~а.е.м.}=\frac{1,6735 \cdot 10^{-27}~кг}{1,66 \cdot 10^{-27}~кг}=1,00813 \approx 1~а.е.м.,}$
а кислорода:
$\mathrm{A_{r}(O)=\frac{m_{a}(O)}{1~а.е.м.}=\frac{26,56 \cdot 10^{-27}~кг}{1,66 \cdot 10^{-27}~кг} \approx 16~а.е.м.}$
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными значениями этих величин.
РЕШЕНИЕ ЗАДАЧ
Задача 1. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны:
$\mathrm{A_{r}(Hg)=201~а.е.м.}$
$\mathrm{A_{r}(Ca)=40~а.е.м.}$
Масса атома ртути равна:
$\mathrm{m_{a}(Hg)=A_{r}(Hg) \cdot 1,66 \cdot 10^{-27}~кг}$
Масса атома кальция равна:
$\mathrm{m_{a}(Ca)=A_{r}(Ca) \cdot 1,66 \cdot 10^{-27}~кг}$
Найдём отношение их масс по формуле:
$\mathrm{\frac{m_{a}(Hg)}{m_{a}(Ca)}=\frac{A_{r}(Hg) \cdot 1,66 \cdot 10^{-27}~кг}{A_{r}(Ca) \cdot 1,66 \cdot 10^{-27}~кг}=\frac{A_{r}(Hg)}{A_{r}(Ca)}=\frac{201}{40}=5,03}$
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс.
$\mathrm{Ответ:~\frac{m_{a}(Hg)}{m_{a}(Ca)}=5,03.}$
Теги материала:



