§19. Расчёты по химических уравнениям

Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
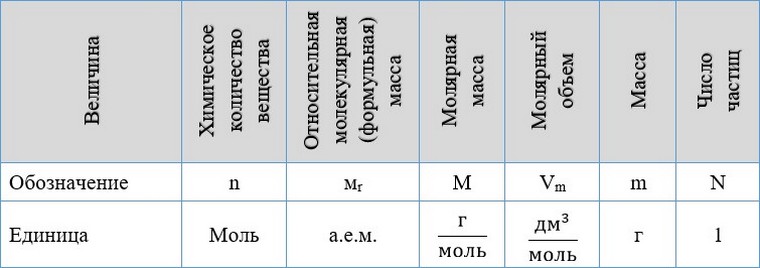
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи.
Особое внимание обратите на расстановку коэффициентов, так как отношение числа структурных единиц, реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
$\mathrm{\color{cyan}{2}Fe+ \color{orange}{3}Cl_{2}= \color{red}{2}FeCl_{3}}$
$\mathrm{\color{cyan}{2}~молекулы - \color{cyan}{2}~моль;~\color{orange}{3}~молекулы - \color{orange}{3}~моль;~\color{red}{2}~молекулы - \color{red}{2}~моль;}$
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на примере.
Пример 1. Вычислить массу FeCl3 образующегося при взаимодействии железа массой 224 г с избытком хлора.
Дано:
$\mathrm{m(Fe)=224~г}$
$\mathrm{m(FeCl_{3})-?}$
Решение:
1. Определяем химическое количество железа:
$\mathrm{n(Fe)=\frac{m(Fe)}{M(Fe)}}$
$\mathrm{M(Fe)=M_{r}(Fe)=A_{r}(Fe)=56 \frac{г}{моль}}$
$\mathrm{n(Fe)=\frac{224~г}{56 \frac{г}{моль}}=4~моль}$
2. Записываем уравнение химической реакции. Подчёркиваем формулы интересующих нас веществ:
$\mathrm{\underline{2Fe}+3Cl_{2}=\underline{2FeCl_{3}}}$
3. Под их формулами записываем химическое количество вступивших в реакцию и образовавшихся веществ:
$\mathrm{\underset{2~моль}{\underline{2Fe}}+3Cl_{2}=\underset{2~моль}{\underline{2FeCl_{3}}}}$
4. Над формулами веществ записываем известные и неизвестные величины по условию задачи:
$\mathrm{\overset{4~моль}{\underset{2~моль}{\underline{2Fe}}}+3Cl_{2}=\overset{X~моль}{\underset{2~моль}{\underline{2FeCl_{3}}}}}$
5. Составляем и решаем пропорцию на основе рассуждения: 2 моль Fe образуют 2 моль FeCl3, 4 моль Fe образуют X моль FeCl3:
$\mathrm{\frac{2}{4}=\frac{2}{X},~ X=\frac{2 \cdot 4}{2}=4~моль.}$
6. Найти массу FeCl3:
$\mathrm{m(FeCl_{3})=n(FeCl_{3} \cdot M(FeCl_{3}))}$
$\mathrm{M_{r}(FeCl_{3})=56+35,5 \cdot 3=162,5~а.е.м.}$
$\mathrm{M(FeCl_{3})=162,5 \frac{г}{моль}}$
$\mathrm{m(FeCl_{3})=4~моль \cdot 162,5 \frac{г}{моль}=650~г}$
$\mathrm{Ответ:~m(FeCl_{3})=650~г.}$
Теги материала:



