§17. Реакции соединения и разложения

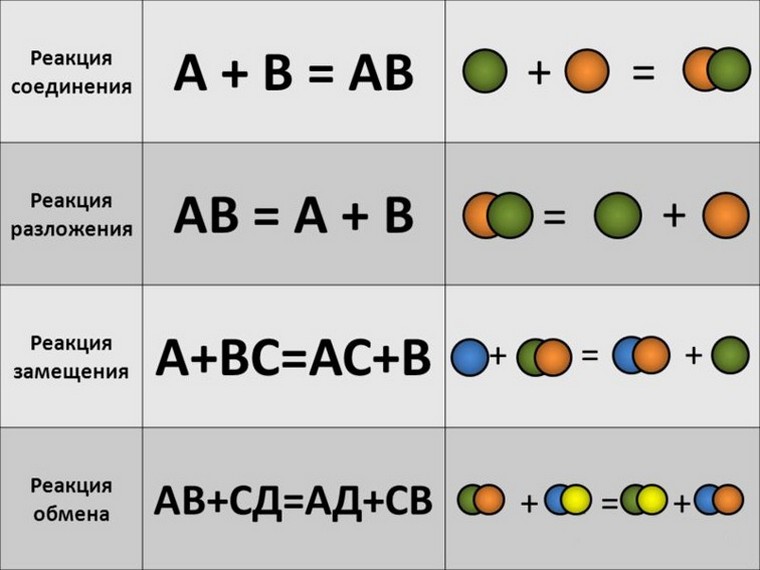
Выделяют 4 типа химических реакций:
1. Соединение (из нескольких веществ образуется одно более сложное)
2. Разложение (из одного сложного образуется несколько новых веществ)
3. Замещение (простое + сложное = простое + сложное)
4. Обмен (сложное + сложное = сложное + сложное)
РЕАКЦИИ СОЕДИНЕНИЯ
Рассмотрим уравнения следующих реакций:
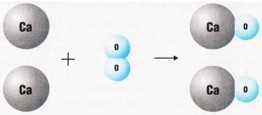
$\mathrm{2Ca+O_{2}=2CaO}$

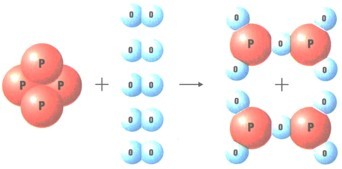
$\mathrm{P_{4}+5O_{2}=2P_{2}O_{5}}$
$\mathrm{3H_{2}+N_{2}=2NH_{3}}$
При взаимодействии двух веществ получается только одно вещество, такие реакции получили название реакций соединения.
В одних случаях из двух простых веществ получается одно сложное вещество, в других — происходят реакции, при которых соединяются два и более сложных веществ. Например:
$\mathrm{4NO_{2}+O_{2}+2H_{2}O=4HNO_{3}}$
$\mathrm{SO_{3}+H_{2}O=H_{2}SO_{4}}$
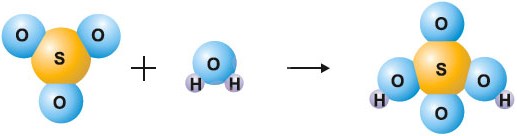
Схема реакции соединения оксида серы(VI) с водой
РЕАКЦИИ РАЗЛОЖЕНИЯ
Рассмотрим уравнения следующих реакций:
$\mathrm{CaCO_{3}=CaO+CO_{2}}$
$\mathrm{2KMnO_{4}=K_{2}MNO_{4}+MnO_{2}+O_{2}}$
$\mathrm{2HgO=2Hg+O_{2}}$
$\mathrm{2KClO_{3}=2KCl+3O_{2}}$
Можно заметить, что из одного сложного вещества получаются два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества, их может быть два и более.
Реакции разложения — это реакции, при которых из одного сложного вещества образуется несколько новых веществ.
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, реакция разложения метана СН4 — составной части природного газа:
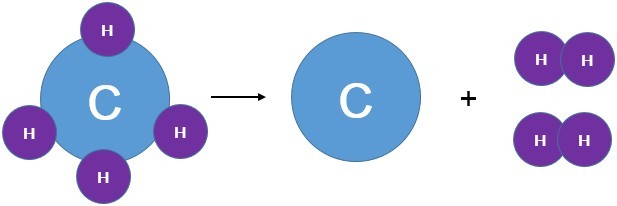
$\mathrm{CH_{4}=C+2H_{2}}$
реакция разложения метана
Пример реакции разложения.
Оранжевые кристаллы - кристаллы дихромата аммония. Горящая лучинка вызывает бурную реакцию. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция.
$\mathrm{(NH_{4})_{2}Cr_{2}O_{7}=Cr_{2}O_{3}+N_{2}+4H_{2}O}$
Окислитель - хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду: мы наблюдаем реакцию разложения соли. Реакция началась от горящей лучинки, но не прекратилась, когда лучинку убрали, а стала еще интенсивней. Дело в том, что в процессе реакции выделяется теплота, и начавшись от лучинки, процесс лавинообразно развивается до тех пор, пока вся масса дихромата не превратится в оксид хрома (III), азот и воду. Оксид хрома – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Теги материала:



