урок 11. Относительная молекулярная и формульная массы

Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается формулой его структурной единицы (молекулярной формулой или формульной единицей). Такая формула состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы также может быть выражена в атомных единицах массы.
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Мr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс химических элементов, образующих данную молекулу. При этом, конечно, необходимо учитывать индексы у символов атомов в молекулярной формуле. Например, рассчитаем относительную молекулярную массу воды Н20:
$\mathrm{M_{r}(H_{2}O)=2 \cdot A_{r}(H)+A_{r}(O)=2 \cdot 1+16=18~а.е.м.}$
Относительная молекулярная масса серной кислоты H2S04:
$\mathrm{M_{r}(H_{2}SO_{4})=2 \cdot A_{r}(H)+A_{r}(S)+4 \cdot A_{r}(O)=2 \cdot 1+32+16 \cdot 4=98~а.е.м.}$
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Мr. Например, относительная формульная масса мела СаСО3, равна:
$\mathrm{M_{r}(CaCO_{3})=A_{r}(Ca)+A_{r}(C)+3 \cdot A_{r}(O)=40+12+16 \cdot 4=100~а.е.м.}$
Относительная формульная масса Al2(S04)3 равна:
$\mathrm{M_{r}(Al_{2}(SO_{4})_{3})=2 \cdot A_{r}(Al)+3 \cdot (A_{r}(S)+4 \cdot A_{r}(O))=2 \cdot 27+3 \cdot(32+16 \cdot 4)=342~а.е.м.}$
Исходя из химической формулы вещества, можно рассчитать массовую долю атомов каждого химического элемента, входящего в его состав.
Массовая доля (W) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
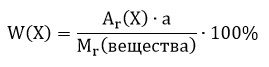 ,
,
где w («дубль-вэ») — массовая доля элемента Х;
Аr(Х) — относительная атомная масса элемента Х;
а - количество атомов элемента Х в веществе;
Мr(вещества) — относительная молекулярная (формульная) масса вещества, в состав которого входит данный элемент Х.
Массовую долю выражают в долях единицы, например 0,07; 0,26; 0,99. Значение массовой доли можно выразить и в процентах. Для этого значение в долях нужно умножить на 100, например W(О) = 0,22, или 22 %.
Масса любого вещества равна сумме входящих в его состав атомов. Т.е. массовая доля всего вещества равна 100%, что составляет сумму массовых долей атомов, входящих в состав вещества.
Итак, сегодня мы узнали:
- Относительная молекулярная масса (Mr) — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
- Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой Мr и высчитывается также как и относительная молекулярная масса.
- Массовая доля химического элемента в веществе равна отношению массы атомов этого элемента к массе всего вещества.
Теги материала:



