§11. Химическое количество вещества. Моль

В жизни мы часто не различаем понятия «масса» и «количество». А это разные понятия. Когда вы говорите: «Я купил 2 кг груш», то здесь речь идет о массе груш. Но если вы говорите: «Я купил 10 груш», то в этом случае речь идет о количестве груш.
Груши можно пересчитать поштучно, а если это, например, зерна? Тут уже посчитать каждое зернышко даже в небольшой емкости сложно. Поэтому зерно обычно продают мешками, т. е. определенными порциями. В каждой такой порции — мешке (если они равны по массе и все зерна одинаковы) будет находиться одно и то же число зерен. Подобным образом продают многие товары. Например, яйца —десятками или дюжинами, спички — спичечными коробками, в каждом из которых находится по 60 спичек.
В химии используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физическая величина называется химическое количество вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Другими словами, химическое количество вещества — это порция данного вещества, содержащая определенное число его структурных единиц.
Химическое количество вещества обозначают латинской буквой n. Это одна из семи основных физических величин Международной системы единиц (СИ).
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в 0,012 кг углерода.
Число (N) атомов в 0,012 кг углерода легко определить, зная массу одного атома углерода (19,94·10-27 кг):
$\mathrm{N=\frac{0,012~кг}{19,94 \cdot 10^{-27}~кг}=6,02 \cdot 10^{23}~атомов}$
Следовательно, в 0,012 кг углерода содержится 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная
$\mathrm{\frac{6,02 \cdot 10^{23}}{1~моль}=6,02 \cdot 10^{23} \cdot{1}{моль}=6,02 \cdot 10^{23}~моль^{-1}}$
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:
$\mathrm{N_{A}=6,02 \cdot 10^{23}~моль^{-1}}$
Если структурной единицей вещества является атом, то, например, 1 моль меди или 1 моль графита содержат по 6,02·1023 атомов.
Если вещество имеет молекулярную структуру, то 1 моль его содержит тоже 6,02·1023 молекул. Например, 1 моль воды, 1 моль углекислого газа, 1 моль глюкозы содержат по 6,02·1023 молекул.
У веществ, у которых структурной единицей является формульная единица, 1 моль, например, NaCI или CuS04, состоит из 6,02·1023 формульных единиц.
Пример: рассчитайте химическое количество кислорода в порции, содержащей 18,03·1023 молекул.
Дано:
$\mathrm{N(0_{2})=18,03 \cdot 10^{23}~молекул}$
$\mathrm{n(O_{2})-?}$
Решение:
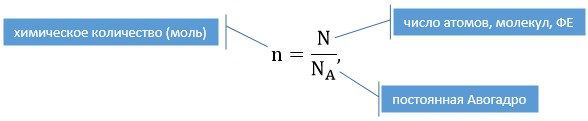
$\mathrm{n=\frac{N}{N_{A}};}$
$\mathrm{n(O_{2})=\frac{18,03 \cdot 10^{23}}{6,02 \cdot 10^{23}}=2,99~моль}$
$\mathrm{Ответ:~n(O_{2})=2,99~моль.}$
ЭТО ИНТЕРЕСНО
Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале XX в. Автор этого термина известный немецкий химик и физик В. Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Площадь поверхности Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023 песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Теги материала:



